Синтез новых ДНК-биосенсоров для определения митохондриального гена стерильности пыльцы подсолнечника
Аннотация
Разработаны и синтезированы высокоспецифичные олигонуклеотиды (праймеры) и флуоресцентный зонд маркирующие митохондриальный ген orf522ЦМС РЕТ1 подсолнечника. Проведена апробация протокола энзиматической амплификации в режиме Real Time PCR.
Ключевые слова: Биосенсоры, гены, ДНК-маркеры.01.04.15 - Физика и технология наноструктур, атомная и молекулярная физика
Подсолнечник (Helianthus annuus L.) является основной масличной культурой России и входит в пятерку главных масличных культур мира. На территории Российской Федерации на его долю приходится около 80 % площади посевов всех масличных культур и до 90 % производимого растительного масла (Келигов, 2009; Повстяной, 2009). Одна из основных целей селекции подсолнечника состоит в увеличении урожая семян. Основу современного промышленного производства семян подсолнечника составляют гетерозисные межлинейные гибриды, создаваемые при скрещивании линий, носителей цитоплазматической мужской стерильности (ЦМС) типа РЕТ1, на основе однолетнего дикорастущего вида H. petiolaris, с формами, имеющими ядерные доминантные гены восстановления фертильности пыльцы Rf1 и Rf
Материал и методы:
Для идентификации митохондриального гена orf522 ЦМС РЕТ1 подсолнечника, синтезировали специфичные праймеры и зонд. (таблица 1)
Таблица 1
Характеристика праймеров и зонда, использованных в Real-Time ПЦР-анализе геномной ДНК растений подсолнечника для определения гена orf522
Последовательность нуклеотидов 5′-3′ |
Температура отжига, 0 С |
Насыщенность GC-пар, % |
Длина |
|
Праймер 1 (forward) |
58,7 |
50 |
24 |
|
Праймер 2 (reverse) |
59,5 |
50 |
24 |
|
Зонд: ACAGATCACGCCCTATAAAGGCCGAA |
61,4 |
50 |
26 |
Праймеры (олигонуклеотиды) целевого фрагмента митохондриального гена orf522 и флуоресцентный зонд синтезирован в рамках проекта ЦКП «Высокие технологии» госконтракт № 16.552.11.7024 (2011-2012г) на ДНК-синтезаторе ASM-800 (Биоссет, г. Новосибирск, Россия) в направлении от 3′- к 5′-концу методом твёрдофазного синтеза в соответствии со стандартными протоколами фирмы-производителя. Автоматический ДНК-синтезатор ASM-800 эксплуатировался при следующих условиях:
- температура окружающего воздуха 17-30о С
- относительная влажность 10-90 %
В качестве рабочего газа использовался газообразный гелий с содержанием:
- объемной доли гелия не менее 99,99 %;
- объемной доли кислорода не более 0,003 %;
- объемной доли водяных паров не более 0,003 %.
Синтез проводили амидофосфитным методом с использованием стандартных коммерческих реагентов в условиях модифицированных нами программ реакционных циклов. Для реакционных циклов с введением 3′-тиофосфорильных звеньев вместо стандартного окислителя, содержащего йод и воду, применяли свежеприготовленный 0,05 М раствор 3H-1,2-бензодитиол-3-он-1,1-диоксида (Glen Research, США) в ацетонитриле. Деблокирование и расщепление связи олигомера с носителем осуществляли с использованием стандартных процедур. Полученные препараты олигомеров анализировали методами ВЭЖХ, MALDI-TOF MS (Matrix Assisted Laser Desorption/Ionization Time-of-Flight Mass Spectrometry), УФ-спектрофотометрией и электрофорезом в ПААГ. Синтезированные олигонуклеотиды хранили в виде водного раствора при -20о С до использования.
Оценку работы праймеров и зонда проводили в энзиматической реакции амплификации в режиме реального времени. В качестве образцов служила тотальная ДНК выделенная методом сорбции на силикагеле из первого листа растений подсолнечника линий ЦМС РЕТ1 (ЭД 169, ЭД 236, IS1544) восстановителей фертильности пыльцы (Rt991, XФ4917, ВД114) и гибридов полученных на их основе.
Протокол проведения Real-Time ПЦР представлен на рисунке.
ПРОТОКОЛ ИЗМЕРЕНИЙ
![]()
Название Теста |
Multiplex |
|
Начало Теста |
26.09.2011 13:35:02 |
|
Тест Закончен |
26.09.2011 14:47:28 |
|
Тест. выполнен программой версии |
Rotor-Gene 1.8.11 |
|
Уровень сигнала Green |
5, |
|
Уровень сигнала Yellow |
5, |
|
Уровень сигнала Orange |
5, |
|
Уровень сигнала Red |
5, |
Количеств. Информация
Левый порог |
1,000 |
|
Станд. кривая импортирована |
Нет |
|
Станд. кривая (1) |
N/A |
|
Станд. кривая (2) |
N/A |
|
Начать нормализацию с цикла |
1 |
|
Noise Slope Correction |
Нет |
|
Порог No Template Control |
0% |
|
Порог Эффективности Реакции |
Отключён |
|
Метод нормализации |
Динамич. фон нормализация |
|
Цифровой Фильтр |
Лёгкий |
|
Страница образцов |
orf522 |
|
Импортированные Установки анализа |
Профиль
Цикл |
Точка Цикла |
|
Удерж. темп-ры 95°c, 5 мин. 0 сек. |
|
|
Cycling (35 повторов) |
Step 1 T 58°c, Удерж. темп-ры 30 сек., Детекция в Циклирование A([Green][1][1],[Yellow][2][2]) |
|
Step 2 T 95°c, Удерж. темп-ры 15 сек., Детекция в Циклирование B([Green][1][1],[Orange][3][3],[Red][4][7],[Yellow][2][2]) |
Raw Data For Cycling A.Yellow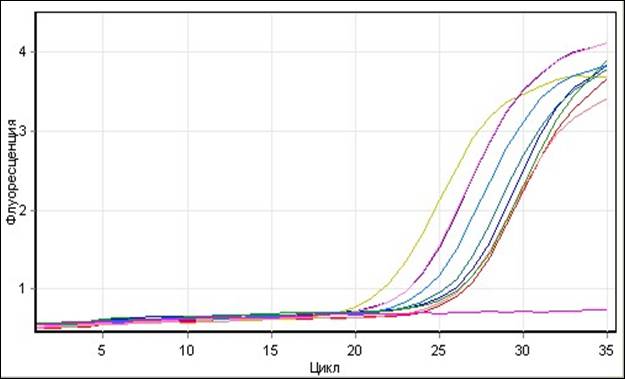
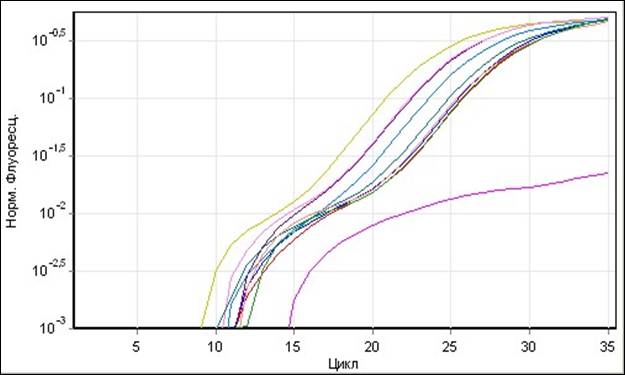
|
№ |
Имя |
Тип |
|
1 |
ЭД 169 |
Образец ЦМС РЕТ1 |
|
2 |
ЭД 236 |
Образец ЦМС РЕТ1 |
|
3 |
IS1544 |
Образец ЦМС РЕТ1 |
|
4 |
RT991 |
Образец восстановитель фертильности |
|
5 |
XF4917 |
Образец восстановитель фертильности |
|
6 |
VD114 |
Образец восстановитель фертильности |
|
7 |
ЭД 169xJ-8/RT991 |
Образец гибрид |
|
8 |
ЭД 236xJ-8/XF4917 |
Образец гибрид |
|
9 |
IS1544xVD114 |
Образец гибрид |
|
1 |
H2Odd |
Контроль |
|
|
Этот Отчёт сгенерирован Rotor-Gene Real-Time Analysis программой Rotor-Gene 6000 Series Software 1.8 (Build 11) |
В условиях Real-Time ПЦР, маркер гена orf522 определен, как и ожидалось, у всех исследованных линий и гибридов подсолнечника, что обусловлено единой цитоплазмой в происхождении этих линий, несущих мутацию в митохондриальном геноме. Полученные результаты демонстрируют 100% идентификационную возможность Real-Time ПЦР с разработанными высокоспецифичными праймерами и флуоресцентным зондом.
Работа выполнена при финансовой поддержке Минобрнауки, грант ФЦП «Проведение центром коллективного пользования научным оборудованием «Высокие технологии» Южного федерального университета поисковых научно-исследовательских работ в области создания экологически чистых технологий получения новых активных нано- и микроструктурированных материалов для использования в современной сенсорике», госконтракт № 16.552.11.7024.
Список литературы
- 1.Гаврилова В. А. Доноры восстановления фертильности пыльцы линий ЦМС подсолнечника для гетерозисной селекции / В.А. Гаврилова, В.Т. Рожкова // Идентифицированный генофонд растений и селекция / Под ред. Б.В. Ригина, Е.И. Гаевской. – Санкт-Петербург. – 2005. - С. 377-389.
2.Келигов И. А. Влияние сроков и норм посева семян на урожайность подсолнечника в Приазовской зоне Ростовской области / И.А. Келигов // Дис... канд. с.-х. наук. – Персиановский, 2009. - 152 с.
3.Повстяной В. В. Удобрение подсолнечника в двух видах севооборотов на обыкновенном черноземе Западного Предкавказья / В.В. Повстяной // Дисс… канд. с.-х. наук. – Краснодар, 2009. – 174 с.
4.Gagliardi, D. Polyadenylation accelerates the degradation of the mitochondrial mRNA associated with cytoplasmic male sterility in sunflower / D. Gagliardi, C.J. Leaver // EMBO J. – 1999. – Vol. 18. – P. 3757-3766. Serieys H. Identification, study, and utilization in breeding programs of new CMS sources / H. Serieys // Helia. - 1999. - Vol. 22. - P. 71-84.
